2021年8月28日,深圳微芯生物科技股份有限公司(以下简称“微芯生物”,股票代码:688321.SH)公告称公司自主研发的CS12192用于治疗移植物抗宿主病(GVHD)的新药临床试验申请(Investigational New Drug Application,IND)于近日获美国食品药品监督管理局(United States Food and Drug Administration,US FDA)批准。
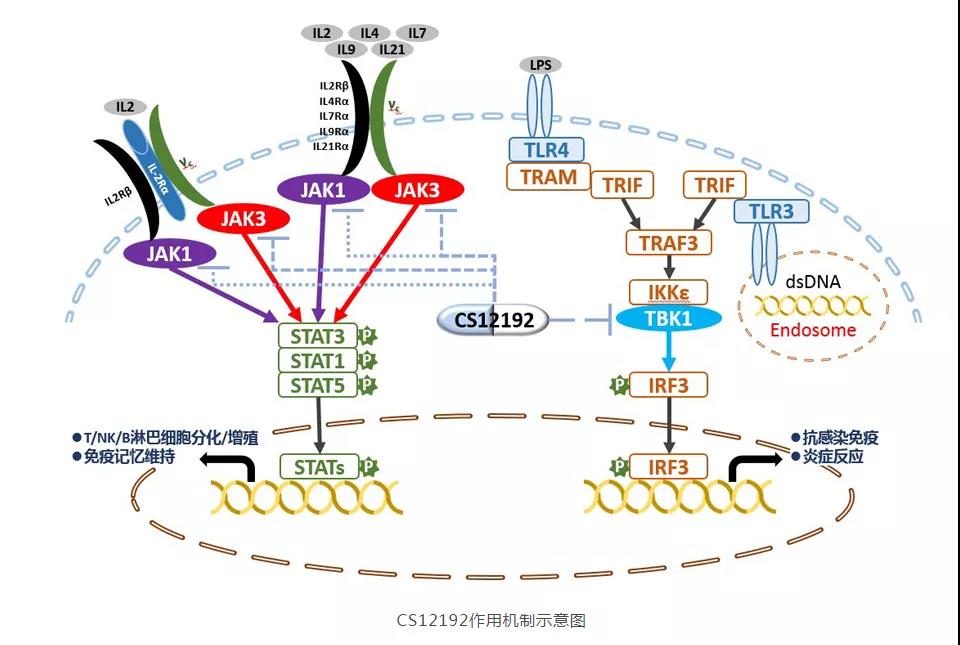
CS12192是微芯生物自主研发的已获全球化合物发明专利授权的高选择性JAK3激酶抑制剂,同时部分抑制JAK1和TBK1激酶,目前尚没有此类抑制剂药物上市。
已完成的临床前研究表明,CS12192在类风湿性关节炎、多发性硬化病、系统红斑狼疮、银屑病等自身免疫性疾病模型及移植物抗宿主病(GVHD)模型上均具有明显的药效活性,在部分疾病模型上显示出有别于其他JAK激酶的差异化药效特征。与已上市的JAK激酶抑制剂相比,CS12192不但能有效抑制免疫细胞过度活化介导的炎症,同时通过抑制TBK1减轻免疫细胞的组织侵袭,有望为自身免疫相关性疾病临床治疗提供一种新的差异化治疗选择。
微芯生物董事长兼总经理鲁先平博士表示,“随着美国FDA对CS12192临床试验申请的批准,将进一步提升我们基于中国早期临床试验的疗效和安全性数据支持下的全球开发策略的成功率。”
关于微芯生物
深圳微芯生物科技股份有限公司(以下简称“微芯生物”,股票代码:688321.SH)是由资深留美归国团队于2001年创立的现代生物医药企业。公司专长于原创新分子实体药物研发,致力于为全球患者提供价格可承受的、临床亟需的、具有革命性疗效的创新机制药物。
凭借自主创建的国际先进的“基于化学基因组学的集成式药物发现及早期评价平台”在肿瘤、代谢性疾病、自身免疫性疾病、中枢神经性疾病和抗病毒等五个重大疾病领域已开发出包括西达本胺(已上市)、西格列他钠(已递交上市申请并获受理)、西奥罗尼(已进入临床Ⅲ期)和CS12192(Ⅰ期临床试验开展中)在内的多个原创新药产品线。
目前,微芯生物拥有以深圳总部/研发中心/GMP生产基地全资子公司深圳微芯药业有限责任公司、成都区域总部/研发中心/GMP生产基地全资子公司成都微芯药业有限公司、北京分公司(临床研究中心)、上海分公司(商业中心)及微芯生物科技(美国)有限公司的全球化产业布局。同时,作为国家首批“创新药物孵化基地”,国家高新技术企业,公司独立承担数十项国家“863”、“十五”、“十一五”、“十二五”及“十三五”国家重大科技专项及“重大新药创制”项目。累计申请境内外发明专利200余项,90余项已获授权。
