荃信生物QX005N注射液获批临床
2020年6月22日,荃信生物再传佳讯,公司研发的第二款具有自主知识产权的创新型单抗QX005N正式获得国家药品监督管理局(NMPA)临床试验批准,临床适应症为特应性皮炎。
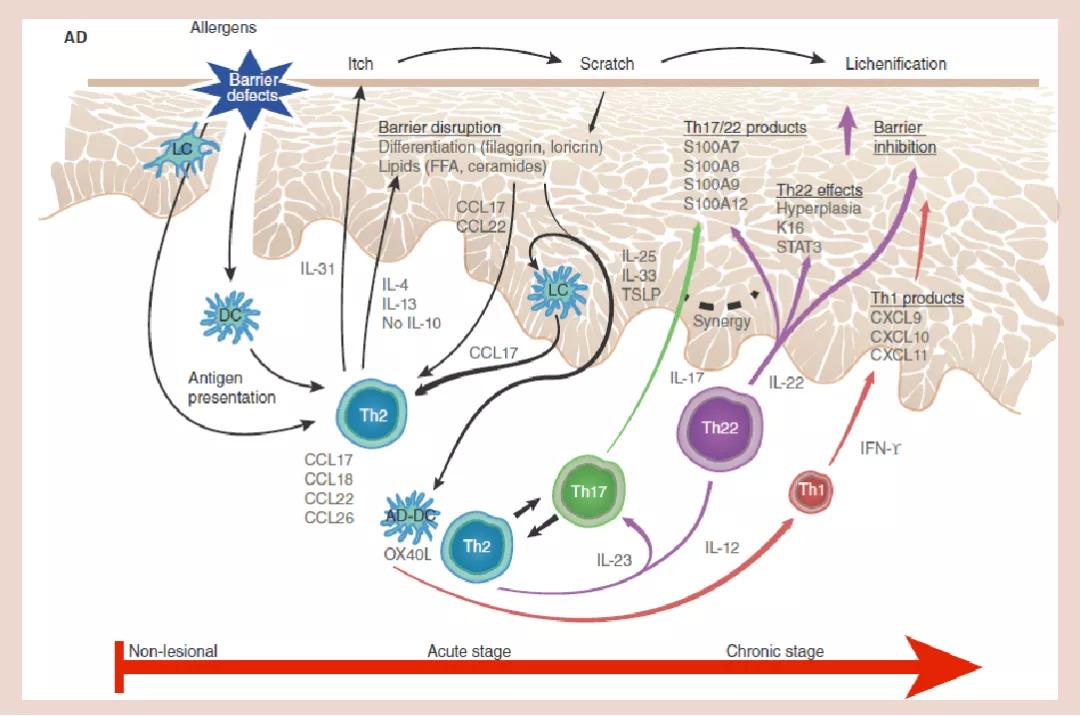
图片来源:Drug evaluation review:dupilumab in atopicdermatitis
特应性皮炎(AD),往往被称为湿疹,具有慢性、复发性、炎症性的特点。这一疾病影响全球5%-10%的成年人和10%-15%的儿童,以剧烈的持续性瘙痒和大面积皮肤损伤为主要临床表现,并导致睡眠障碍、抑郁等精神负担。数据显示,63%的患者每天承受12小时以上的剧烈瘙痒,55%的患者每周有5-7天睡眠受到干扰,75%以上的患者存在由皮肤开裂、结痂和渗液等引起的疼痛和不适症状。
特应性皮炎如得不到有效控制,会影响患者的情绪和心理状态,导致焦虑和抑郁以及孤独感。调查显示,39%的患者对自己的外表感到难堪, 6%的中度特应性皮炎患者和19.6%的重度患者有过自杀意念。特应性皮炎的患病率以及疾病负担的严重性,在皮肤类疾病中数一数二,而且患者常合并哮喘、过敏性鼻炎等疾病,不仅增加了患者的痛苦,同时也给临床治疗增加了难度。
目前对于这一疾病的治疗缺乏有效且安全的手段,外用激素等局部疗法对中重度特应性皮炎患者疗效有限且难以长期使用,而免疫抑制剂或口服糖皮质激素等系统性治疗方式有可能导致严重的副作用。
关于QX005N注射液
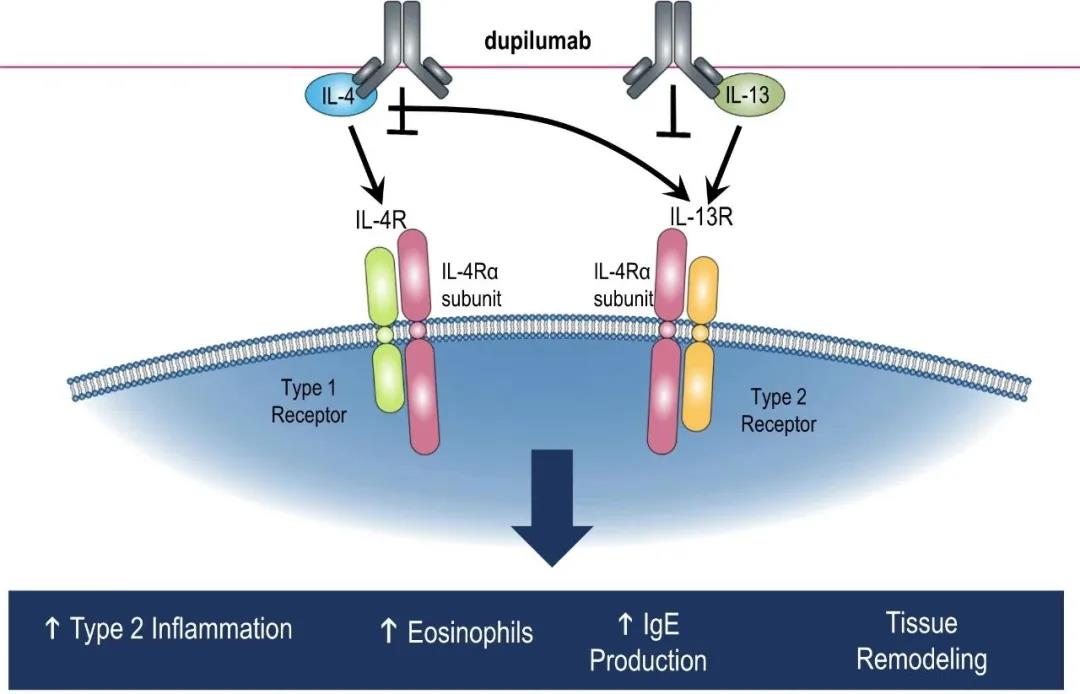
图片来源:Regeneron官网
QX005N注射液是由荃信生物自主研发的生物制品1类新药,具有全新的抗体结构,已申请国家发明专利及PCT国际发明专利。QX005N为特异性结合人IL-4R的人源化单克隆抗体,通过抑制IL-4/IL-13同靶细胞表面受体结合诱导的下游信号通路发挥相应生物学效应,拟开发适应症包括特应性皮炎、哮喘、鼻窦炎伴鼻息肉等过敏性疾病。
临床前研究结果显示,QX005N注射液在抗体结构、药效学、药代动力学及安全性方面均表现出良好的特性和优越性。同类药物赛诺菲的IL-4R拮抗剂Dupixent(Dupilumab)是全球唯一获批治疗中重度特异性皮炎(AD)的生物制剂,已获批的适应症还包括中重度哮喘及鼻窦炎伴鼻息肉,2019年全球销售额已达20.74亿欧元;未来3年Dupixent预计还将陆续斩获结节性痒疹(PN)、嗜酸性细胞性食管炎(EoE)、慢性荨麻疹(CSU)、大疱性类天疱疮、2型炎症COPD等新的适应症,赛诺菲对Dupixent的销售峰值预期超过100亿欧元。
关于荃信生物

荃信生物是一家临床阶段的生物药物公司,专注于创新开发治疗自免和过敏所致严重慢性炎症的抗体药物。依托公司独特的抗体发现平台和分子免疫生物学平台,致力于解决关注领域内的药物可及性问题,为临床和病患提供更多、更好的治疗选择。
自免领域,公司新药管线重点布局Th17信号途径,包括QX001S、QX002N、QX004N和QX006N。除了刚完成I期临床试验的QX001S,专利药QX002N的Ia期临床研究也接近尾声,现有数据表明QX002N具有优秀的安全性和药物代谢特征。
过敏领域,公司新药管线重点布局Th2信号途径,新药管线包括QX005N、QX007N和QX008N。
