2020 半年报
亚盛医药(6855.HK)近日公布了截至2020年6月30日的中期业绩。报告期内,公司在临床开发、对外合作、专利布局等方面均获得较大进展,特别是今年6月递交公司首个新药上市申请(NDA),迎来重大里程碑。创新投入持续加码,产品管线进一步扩充
公司2020年上半年研发支出为人民币2.5亿元,创新投入持续加码。截至2020年6月30日,亚盛医药已构建包括八个处于临床阶段的小分子候选药物在内的丰富在研产品线,在中国、美国及中澳大利亚有超过40项I期或II期临床试验正在进行中。公司研发产品管线主要专注细胞凋亡路径关键蛋白的抑制剂,通过抑制Bcl-2/Bcl-xL、IAP、MDM2-p53 等,重启肿瘤细胞的凋亡程序;以及新一代针对癌症治疗中出现的激酶突变体的抑制剂等。
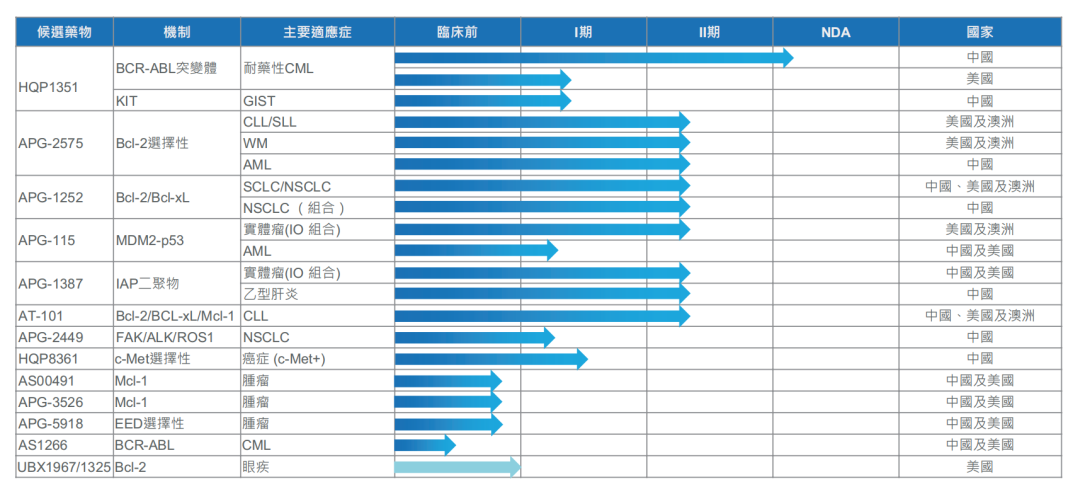
亚盛医药产品管线图
在现有八个已进入临床开发阶段的候选药物之外,公司产品管线进一步扩充,包括临床前候选药物Mcl-1抑制剂AS00491、APG-3526,EED抑制剂APG-5918,以及尚处探索阶段的第四代BCR-ABL抑制剂AS1266。
全球临床开发全面推进, 递交首个新药上市申请
报告期内在研产品取得重大进展,全球临床开发全面推进,并递交公司首个NDA。
作为亚盛医药的核心产品,第三代BCR-ABL/KIT抑制剂HQP1351在报告期内迎来多项重大里程碑。2020年6月,基于两项关键性注册临床研究的结果,公司向国家药品监督管理局(NMPA)新药审评中心(CDE)递交HQP1351的新药上市申请(NDA),用于治疗伴有T315I突变的慢性髓性白血病(CML)慢性期和加速期患者。这是亚盛医药创立以来的第一个新药上市申请,也将有望成为国内首个上市的第三代BCR-ABL抑制剂。对一代及二代TKI耐药╱不耐受的第三项关键性研究进行中,并正在积极进行患者招募。报告期内,HQP1351还接连获得美国FDA授予的孤儿药资格和审评快速通道资格,国际化开发同步推进。
亚盛医药细胞凋亡管线主要产品APG-2575为新型口服Bcl-2选择性抑制剂,是首个进入临床阶段的国产Bcl-2选择性抑制剂。自今年3月以来,APG-2575在美国、中国获得多项Ib/II期研究的临床许可,全面推进多个血液肿瘤适应症的临床开发。在美国,APG-2575接连获得FDA两项临床许可,将分别开展作为单药或联合治疗复发/难治慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL) 、华氏巨球蛋白血症(WM)的全球Ib/II期临床研究。其中,关于治疗复发/难治CLL/SLL的全球Ib/II期研究,已迅速在美国完成首例患者给药。在中国,APG-2575已获CDE临床许可,将开展单药或联合治疗复发/难治急性髓系白血病(AML)的Ib期研究,以及单药或联合治疗复发/难治CLL/SLL的Ib/II期临床研究。尤其值得关注的是,今年7月,APG-2575又下一城,获得美国FDA孤儿药资格认定,用于治疗WM。
除此之外,包括原创双靶点Bcl-2/Bcl-xL抑制剂APG-1252、MDM2-p53抑制剂APG-115和IAP抑制剂APG-1387在内的其他在研产品都取得较大进展,多项数据入选今年ASCO(美国临床肿瘤学会)年会和AACR(美国癌症研究协会)年会,进一步呈现国际影响力。
达成多项国际战略合作,积极探索联合治疗
除了构建强大的内部研发团队外,亚盛医药一直保持与领先的跨国药企、生物技术医药公司及学术机构建立全球合作关系。报告期内,公司达成多项全球性合作,并积极探索多个疾病领域的联合治疗。
今年6月,公司与阿斯利康血液研发卓越中心Acerta制药达成全球临床合作,将探索Bcl-2选择性抑制剂APG-2575与BTK抑制剂CALQUENCE® (acalabrutinib)的联合治疗,以评估该联合用药在复发难治CLL/SLL患者中的临床效果。
7月,公司公布与MSD达成全球临床研究合作,探索MDM2-p53抑制剂APG-115联合KEYTRUDA®(帕博利珠单抗)治疗晚期实体瘤。
此外,公司与国家血液系统疾病临床研究中心于7月达成战略合作,将共建国家血液系统疾病临床医学研究中心亚盛研究院,加码血液肿瘤领域的研究及临床开发。
不断拓展的全球合作网络可为公司提供全球认可及提升品牌知名度,亦可提供获取主要药物及候选药物的更佳途径,以更好的推进产品开发。
加强全球知识产权布局,巩固行业领先地位
作为立足中国、面向全球的原创新药研发企业,知识产权布局对公司业务发展至关重要。凭借强大的研发能力,亚盛医药持续在全球层面进行策略性知识产权布局,并在全球范围内拥有候选产品的授权专利或专利申请的独占许可。截至2020年6月30日,公司已在全球拥有96项授权专利及300余项专利申请,其中80项专利已在海外授权。

亚盛医药董事长、CEO杨大俊博士表示:
2020年上半年,在全球遭遇新冠疫情的特殊情况下,我们克服困难,实现诸多突破,特别是递交了公司创立以来的首个新药上市申请,再创公司发展里程碑,迈出从研发企业走向有产品上市企业的重要步伐;我们继续大力推进全球层面的临床开发,包括APG-2575在内的细胞凋亡条线系列品种,都获得较大进展,相关数据也频频亮相权威学术会议,公司的国际学术影响力持续增强;我们的国际合作步伐加快,上半年相继与阿斯利康、默沙东及国家血液系统疾病临床中心等跨国药企和学术机构建立全球合作,以推进产品开发。
展望未来,我们将不断提高研发能力,加强全球知识产权布局,巩固行业领先地位;我们将加速推进现有产品管线的全球临床开发进度,进一步推动HQP1351新药上市申请进程,尽快实现产品上市,真正践行“解决中国乃至全球患者尚未满足的临床需求”使命,造福更多患者。同时,我们也持续关注财务健康发展,保障股东投资者利益。
关于亚盛医药
亚盛医药是一家立足中国、面向全球的处于临床开发阶段的原创新药研发企业,致力于在肿瘤、乙肝及与衰老相关的疾病等治疗领域开发创新药物。2019年10月28日,亚盛医药在香港联交所主板挂牌上市,股票代码:6855.HK。
亚盛医药拥有自主构建的蛋白-蛋白相互作用靶向药物设计平台,处于细胞凋亡通路新药研发的全球最前沿。公司已建立拥有8个已进入临床开发阶段的1类小分子新药产品管线,包括抑制Bcl-2、IAP 或 MDM2-p53 等细胞凋亡路径关键蛋白的抑制剂;新一代针对癌症治疗中出现的激酶突变体的抑制剂等,为全球唯一在细胞凋亡路径关键蛋白领域均有临床开发品种的创新公司。目前正在中国、美国及澳大利亚开展40多项I/II期临床试验。用于治疗耐药性慢性髓性白血病的核心品种HQP1351获得美国FDA审评快速通道及孤儿药认证资格,并已在中国递交新药上市申请。公司的另一重要品种APG-2575近期也获得美国FDA孤儿药资格认证。
前瞻性声明
本文所作出的前瞻性陈述仅与本文作出该陈述当日的事件或资料有关。除法律规定外,于作出前瞻性陈述当日之后,无论是否出现新资料、未来事件或其他情况,我们并无责任更新或公开修改任何前瞻性陈述及预料之外的事件。请细阅本文,并理解我们的实际未来业绩或表现可能与预期有重大差异。本文内所有陈述乃本文章刊发日期作出,可能因未来发展而出现变动。亚盛医药细胞凋亡新药研发全球领先者
